グルフォスファミド開発
Glufosfamide(以下「グルフォスファミド」)は、難治性がんの代表といわれるすい臓がんをはじめ、複数の固形がんに対する抗がん作用が確認されている広い抗がんスペクトルを有する薬剤です。
当社グループは2004年、米国NASDAQ上場企業であるThreshold Pharmaceuticals, Inc.(以下「スレッシュホールド社」)とグルフォスファミドについて共同開発契約を結び、日本を含めたアジア地域での共同開発支援を行う権利を得ました。2009年、スレッシュホールド社が米国バイオベンチャーEleison Pharmaceuticals LLC(以下「エライゾン社」)に同剤の開発・販売権を譲渡したことを受け、当社とスレッシュホールド社の共同開発契約もエライゾン社に引き継がれ、第Ⅲ相臨床試験が2013年10月より開始しております。

図1.すい臓とその周囲の臓器
file from wikimedia commons
すい臓がんはどんな病気?
すい臓は胃の後ろ側にある長さ20cm前後の細長い臓器で、右側の頭部から左側の尾部に向かって細くなる洋ナシのような形をしています(図1)。
すい臓の主な働きは、アミラーゼやリパーゼなどの消化酵素を含んだ消化液をつくること(外分泌機能)と、インスリンやグルカゴンなど、血糖の調節に必要なホルモンをつくること(内分泌機能)です。血流および神経が多く分布し、胃や十二指腸、大腸、腎臓、脾臓などの重要な臓器や主要脈管と隣り合っているため、手術しにくい臓器とされています。
すい臓から発生したがんのことを一般にすい臓がんと呼び、その90%以上は膵管にできる膵管がんです。すい臓がんは、消化器がんのなかでも特に治りにくい難治性がんとされています。その理由として、すい臓が身体の奥深くにあって診断しにくいこと、すい臓がんに特異的な初期症状がなく早期発見が難しいこと、膵管には上皮細胞の下にがんの進行を防ぐ組織がないためがんが拡がりやすく、すい臓がんと診断された患者さんの大半は切除手術の対象にならないほど進行していること、さらに切除した場合でも早期に再発しやすいことが挙げられます。
グルフォスファミドとは
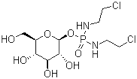
Molecular Weight : 383.16
図2.分子構造
グルフォスファミドは、骨肉腫・前立腺癌などのがんに使われているイホスファミドの活性化合物にグルコースを結合した低分子化合物です(図2)。低酸素状態にあるがん細胞は、細胞増殖を維持するために正常な細胞よりも多くの糖を取り込む性質があり、糖鎖を持つグルフォスファミドは、この糖の取り込みを利用してがん細胞内に選択的・優先的に移行します(図3-1)。
グルコーストランスポーターを介してがん細胞に取り込まれた薬剤は、細胞内でグルコースと活性化合物に分かれ、抗がん作用を発揮するプロドラッグです(図3-2)。また、イホスファミドが膀胱出血を伴う重篤なリスクがあるのに対し、グルフォスファミドは副作用が少ないといわれています。
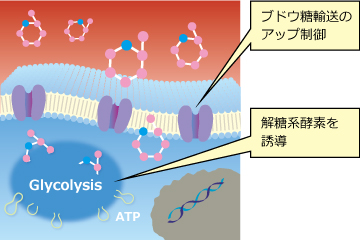
図3-1.解糖によってエネルギー生産用グルコースの蓄積を増加
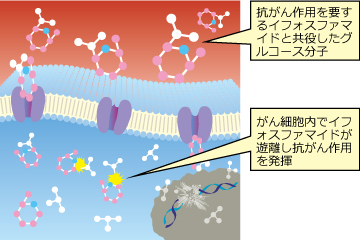
図3-2.グルコーストランスポーターを介した
グルコース結合分子の選択的・優先的な細胞内取り込み
現在、すい臓がんの治療にはゲムシタビン(商品名:ジェムザール)が最も多く使われていますが、十分な効果が得られないケースも少なくありません。グルフォスファミドは、ゲムシタビンでは効果がみられない転移性すい臓がんの治療薬として、米国食品医薬品局(FDA)よりファーストトラック(優先開発対象医薬品)の認定を受けています。これまでに行われた臨床試験で、グルフォスファミドとゲムシタビンを併用することで、新たな副作用の発現がなく、より強力な抗がん作用が認められています。
さらに、グルフォスファミドの臨床試験ですい臓がん以外にも複数のがん種(乳がん、肺がん、大腸がん、軟部組織肉腫など)で腫瘍の縮小効果が見られており、今後の開発が期待されています。
開発の歩み
グルフォスファミドの抗腫瘍効果は、米国のグローバルヘルスケア企業バクスター社によって発見され、抗がん剤としての開発が進められてきました。2003年、スレッシュホールド社はバクスター社よりグルフォスファミドの独占開発権を取得し、2004年にFDAに新薬治験申請(IND)を行い欧米での臨床試験が進められてきました。
これまでに、4つの第Ⅰ相臨床試験、9つの第Ⅱ相臨床試験、および1つの第Ⅲ相臨床試験が行われ、460例を超える進行性がんの患者さんがグルフォスファミドの投与を受け、その安全性と効果が検討されました。
第Ⅰ相臨床試験では、従来の抗がん剤治療では効果の得られなかったがん患者さんを対象に、グルフォスファミドの投与量を段階的に増量する方法でまず薬の安全性が評価され、次に各種がんについて腫瘍縮小作用が検討されました。その結果、乳がん、非小細胞肺がん、胸膜中皮腫、腎細胞腫、原発不明がんの患者さんで腫瘍縮小がみられ、進行性すい臓がんの1例では、がんの完全寛解(著効、CR: Complete Response)が認められました。さらに、切除不能な局所進行性あるいは転移性のすい臓がんを対象に、グルフォスファミドとゲムシタビンの併用による第1選択 (1st-line) 治療薬としての評価を行った試験では、新たな副作用の発現がなく、単独投与に比べてより高い抗腫瘍効果が認められました。
第Ⅱ相臨床試験は、複数のがん種を対象とした9つの臨床試験において、進行性すい臓がんでは、部分寛解(有効、PR: Partial Response)が13%に、安定(SD: Stable Disease)が35%と全体で48%の有効性が示されました。その他、大腸がんおよび軟部組織肉腫で高い抗腫瘍効果が認められ、神経膠芽細胞腫以外の乳がん、非小細胞肺がんでも一定の効果が得られました。また、いずれの試験においてもグルフォスファミドの忍容性は高い(良好)薬物でした。
第Ⅲ相臨床試験は、ゲムシタビンによる治療の後にすい臓がんが再発した患者さんを対象に、第2選択 (2nd-line) 治療薬としての有効性が評価されました。その結果、グルフォスファミド投与群の全生存期間は、非投与群に比較して25%の改善がされましたが、統計的な有意差を得るに至りませんでした。その理由は、インスリン投与を受けている2型糖尿病の患者群でグルフォスファミドの有効性が際立って低かったためです。インスリン投与を受けている患者群を除いて再解析したところ、グルフォスファミド投与群において全生存期間に統計的優位差が認められることがわかりました。この知見を生かして、対象患者を絞り込んだ新たな第Ⅲ相臨床試験が進行中です。
日本での臨床試験の薬物動態についても、海外での第Ⅰ相臨床試験データと同様の評価結果であることが確認されました。抗腫瘍効果については、すい臓がん、胆嚢がんなどに効果が期待されることが示唆されました。
エライゾン社は2010年、新たな第Ⅲ相臨床試験プロトコールに関してFDAより特別プロトコール査定(SPA; Special Protocol Assessment、注1)の合意を得ています。同年11月には米国国立衛生研究所 (NIH; National Institute of Health) より、“U.S. Qualifying Discovery Project Program”賞および研究開発費の授与、2011年4月には欧州委員会 (European Commission)においてオーファンドラッグ(希少疾病用医薬品、注2)の指定を受けました。これにより、エライゾン社は、米国でのオーファンドラッグ指定に加えて欧州医薬品庁よりEU圏におけるグルフォスファミドの独占販売権が与えられると同時に、プロトコルサポートや開発援助が受けられるなど優遇措置が講じられることとなります。
(注1)SPA; Special Protocol Assessment
FDAと申請者間で第Ⅲ相臨床試験前に対象疾患、目的、試験デザイン、解析方法などの詳細な取り決めに関して事前合意し、試験終了後は合意内容を変更せずにそのまま承認審査での承認要件として認めるという制度です。この制度を利用することで、より確実な商品の市場への投入が期待できるため、欧米のバイオベンチャーに幅広く活用されています。
(注2)オーファンドラッグ (Orphan Drug)
一般的に希少疾病医薬品といわれ、医療上の必要性が高いにもかかわらず、患者数が少ない難治疾病に対する開発可能性の高い医薬品を指す。オーファンドラッグ指定を受けた場合、税制上の優遇、開発助成金の援助、特許や使用権の延長などの優遇措置が講じられる。




